【中3】中和とイオン
単元:中和とイオン
問題
【実験】
うすい硫酸20mlを試験管に取り、BTB水溶液を2-3滴加えたところ、黄色になった。これを液Aとする。
液Aにうすい水酸化バリウム水溶液を4mlを加えて良く振ると、試験管の底に白色の固体が沈んだ。これを液Bとする。
さらに液Bにうすい水酸化バリウム水溶液を4mlずつ加えていき、それぞれの液をC,D,Eとする。
以下の表は、それぞれの液の色を記録したものである。
| 液 | A | B | C | D | E |
|---|---|---|---|---|---|
| うすい硫酸(ml) | 20 | 20 | 20 | 20 | 20 |
| うすい水酸化バリウム水溶液を加えた回数(回) | 0 | 1 | 2 | 3 | 4 |
| 加えた水酸化バリウム水溶液の総量(ml) | 0 | 4 | 8 | 12 | 16 |
| 液の色 | 黄色 | 黄色 | 黄色 | 青色 | 青色 |
次の問いに答えなさい。
- この実験で、試験管の底に沈んだ固体は何という物質でしょうか。また、このとき起きた化学反応式を書きなさい。
- うすい水酸化バリウム水溶液を加えた4回の操作で、中和が起こったのは何回目か。すべて答えなさい。
- うすい水酸化バリウム水溶液を加えた4回の操作で、新たに白色の固体ができなかったのは何回目ですか。

(1)の問題は、酸とアルカリの反応になります。酸とアルカリの反応では、反応後に必ず塩と水になることがポイントです。
塩は水に溶けるものと溶けないものがあり、溶けないものは反応後に固体として底に沈殿します。
H2SO4→2H++SO42-
Ba(OH)2→Ba2++2OH–
塩は水に溶けるものと溶けないものがあり、溶けないものは反応後に固体として底に沈殿します。
酸+アルカリ→塩+水
硫酸と水酸化バリウムの電離式が次の形であることに注意しましょう。H2SO4→2H++SO42-
Ba(OH)2→Ba2++2OH–

(1)の物質ですが、バリウムイオンと硫酸イオンは、2個電子を失った陽イオンと2個電子を受け取った陰イオン同士なので、そのままくっ付いて、BaSO4(硫酸バリウム)になると考えられます。

正解です。硫酸バリウムは難溶性の代表的な塩ですので覚えておきましょう!
次は化学反応式ですね。
次は化学反応式ですね。

硫酸の化学式は、H2SO4で、水酸化バリウムの化学式は、Ba(OH)2だから、
H2SO4+Ba(OH)2→BaSO4+H2O……
あれ?左と右の式でHとOの数が合いません。どうしたらよいのですか?
H2SO4+Ba(OH)2→BaSO4+H2O……
あれ?左と右の式でHとOの数が合いません。どうしたらよいのですか?

良い質問です。
中和の際は、水素イオン1個に対し、水酸化物イオン1個が反応して水になります。
H++OH–→H2O
水素イオンが2個の場合は、水酸化物イオンが2個が反応して水が2個できます。
2H++2OH–→2H2O
硫酸1個には、水素イオンが2個あるので、硫酸1個に対し、水が2個できます。

えっと…そうすると
H2SO4+Ba(OH)2→BaSO4+2H2Oとなって、
左辺と右辺の水素原子の個数と酸素原子の個数も同じになりました。
H2SO4+Ba(OH)2→BaSO4+2H2Oとなって、
左辺と右辺の水素原子の個数と酸素原子の個数も同じになりました。

正解です。
ちゃんとできてましたが、化学反応式の問題は、左辺、右辺の元素の個数が合っているかどうか確認をするのが、とっても大切です。
ちゃんとできてましたが、化学反応式の問題は、左辺、右辺の元素の個数が合っているかどうか確認をするのが、とっても大切です。

次に(2)について考えてみましょう。
中和の基準となるのは、BTB溶液の色の変化を見て判断します。
・酸性の時、BTB溶液の色は黄色
・中性の時、BTB溶液の色は緑色
・アルカリ性の時、BTB溶液の色は青色
中性の場合は、溶液中に水素イオン、水酸化物イオンのいずれも残っていない場合となります。
中和の基準となるのは、BTB溶液の色の変化を見て判断します。
・酸性の時、BTB溶液の色は黄色
・中性の時、BTB溶液の色は緑色
・アルカリ性の時、BTB溶液の色は青色
中性の場合は、溶液中に水素イオン、水酸化物イオンのいずれも残っていない場合となります。

わかりました。
最初は、うすい硫酸が入っていたので、黄色からスタートしています。
うすい水酸化バリウムを加えていくと、中和が始まるのでBTB溶液が黄色の時は全て、中和反応が起きているから、1回目、2回目は中和が起きています。
3回目は青色になっているのですが、この時は、緑色を飛び越して青色になっているので、3回目も中和が起きていると考えてよいのでしょうか?
最初は、うすい硫酸が入っていたので、黄色からスタートしています。
うすい水酸化バリウムを加えていくと、中和が始まるのでBTB溶液が黄色の時は全て、中和反応が起きているから、1回目、2回目は中和が起きています。
3回目は青色になっているのですが、この時は、緑色を飛び越して青色になっているので、3回目も中和が起きていると考えてよいのでしょうか?

良い質問です。
3回目の操作の際は、中和が起きていると考えられます。
なぜなら、2回目の操作終了時点で、まだBTB溶液は黄色のため、水素イオンが残っているという証拠になるからです。
3回目の操作の際は、中和が起きていると考えられます。
なぜなら、2回目の操作終了時点で、まだBTB溶液は黄色のため、水素イオンが残っているという証拠になるからです。
考え方
水素イオン1個に対し水酸化物イオン1個が反応して水になります。
スタート時点で水素イオンが5個あったとして、1回の操作で、水酸化物イオンが2個反応したと仮定すると、水素イオンは2個ずつ減るので、以下のように考えられます。
| 0回目 | 1回目 | 2回目 | 3回目 | 4回目 | |
|---|---|---|---|---|---|
| 残存水素イオン | 5個 | 3個 | 1個 | 0個 | 0個 |
| 反応した水素イオン | 0個 | 2個 | 2個 | 1個 | 0個 |
| 反応した水酸化イオン | 0個 | 2個 | 2個 | 1個 | 0個 |
| 未反応の水酸化物イオン | 0個 | 0個 | 0個 | 1個 | 3個 |
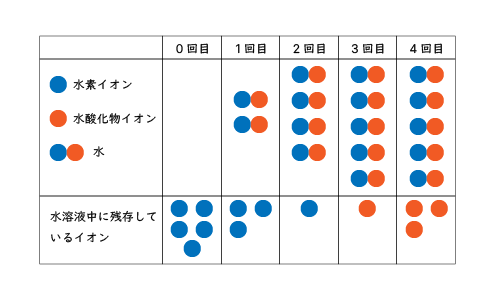

なるほど。2回目では、まだ水素イオンが1個残っているから、3回目で中和反応が起きているのですね。
答えは、1回目、2回目、3回目ですね。
答えは、1回目、2回目、3回目ですね。

正解です。よくできました。
次に(3)を考えてみましょう。
3回目の操作後で、最初にあったすべての水素イオンがすべて中和されて水になっていることがポイントです。
次に(3)を考えてみましょう。
3回目の操作後で、最初にあったすべての水素イオンがすべて中和されて水になっていることがポイントです。

3回目の操作までは中和反応が起きたので、底に沈む硫酸バリウムが回数ごとに増えていったと考えられます。
4回目の操作では、新たに中和反応が起きていないから、答えは4回目ですか?
4回目の操作では、新たに中和反応が起きていないから、答えは4回目ですか?

正解です。
中和反応が完結したあとは、新たな塩ができないと覚えておきましょう。
中和反応が完結したあとは、新たな塩ができないと覚えておきましょう。
ITTO長野の中学生理科プラン
コースの内容は現在の学習状況と志望校などをお伺いしながらご提案しております。詳しくは各教室まで。
化学コース 【中1生】【中2生】【中3生】
| 内容 | 中学1年:身のまわりの物質 中学2年:化学変化と原子・分子 中学3年:化学変化とイオン 中1の気体の発生から中2の化学式・化学反応式、中3のイオンまで化学分野の基礎を身につけるプランです。 |
| 時間割 | 50分授業×週1回 |
| 授業回数 | 月間4回 |
| 月額授業料(税込み) | 【中1生】9,130円 【中2生】9,570円 【中3生】9,790円 |
生物コース【中1生】【中2生】【中3生】
| 内容 | 中1年:いろいろな生物と共通点 中2年:生物のからだのつくりとはたらき 中3年:生命の連続性 入試やテストに出やすい生物分野の単元をピックアップしながらどうしても入れておきたい知識を定着させていくプランです。 |
| 時間割 | 50分授業×週1回 |
| 授業回数 | 月間4回 |
| 月額授業料(税込み) | 【中1生】9,130円 【中2生】9,570円 【中3生】9,790円 |
物理コース【中1生】【中2生】【中3生】
| 内容 | 中1年:身のまわりの現象 中2年:電気の世界 中3年:運動とエネルギー なかなか視覚でとらえられない単元の多い物理分野です。映像や図などで理解しやすく、解説指導していくプランです。 |
| 時間割 | 50分授業×週1回 |
| 授業回数 | 月間4回 |
| 月額授業料(税込み) | 【中1生】9,130円 【中2生】9,570円 【中3生】9,790円 |
地学コース【中1生】【中2生】【中3生】
| 内容 | 中1年:大地の変化 中2年:天気とその変化 中3年:地球と宇宙 地震や堆積岩から身近な天気、天体の日周運動や年周運動を図を使いながら視覚で捉えて理解できるように指導していくプランです。 |
| 時間割 | 50分授業×週1回 |
| 授業回数 | 月間4回 |
| 月額授業料 | 【中1生】9,130円 【中2生】9,570円 【中3生】9,790円 |
計算問題コース【中1生】【中2生】【中3生】
| 内容 | 化学分野:溶解度、濃度、化学反応と質量 物理分野:圧力・浮力、フックの法則、オームの法則、熱量・電力量、仕 事、エネルギー 生物分野:遺伝 地学分野:地震、太陽の日周運動、天体の年周運動、湿度・飽和水蒸気量 公式だけでなく、理屈の理解も絡ませながら少しでも自分のやりやすい計算にしていくのかを一緒に考えながら指導していくプランです。 |
| 時間割 | 50分授業×週1回 |
| 授業回数 | 月間4回 |
| 月額授業料(税込み) | 【中1生】 9,130円 【中2生】 9,570円 【中3生】 9,790円 |









